作者:zoe vinet 7 月以前
196
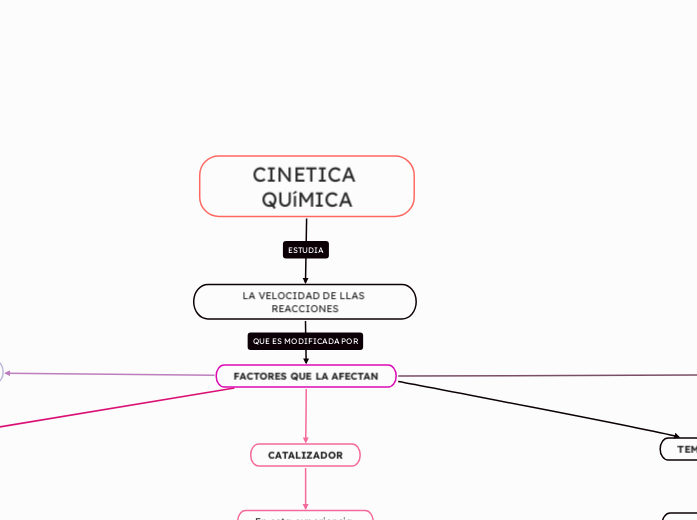
CINETICA QUíMICA
La cinética química estudia la velocidad de las reacciones y los factores que la afectan. La naturaleza de los reactivos es crucial, ya que diferentes compuestos reaccionan a distintas velocidades.
作者:zoe vinet 7 月以前
196

更多类似内容
En esta experiencia
Para la reacción entre KMnO4 y el Na2C2O4 la presencia MNso4
La energía de activación
Como la energía mínima para iniciar una reacción
EXPERIENCIA 3
Na2C2O4, MnO4 y MnSo4
Tiene reacción lenta
MnSo4 disminuye la concentración de los reactivos
KmnO4
Contiene Na2C2O4 y KmnO4
Instantánea
Reacción rápida
comparando la velocidad con la que reacciona el KMnO4 frente a un compuesto iónico como el Na2C2O4.
Que los tipos de enlaces químicos deben romperse y formarse
La complejidad de las moléculas
La cantidad de las moléculas con orientación favorable
Ocurra la reaccion
EXP 1
Iones ferrosos que son fácilmente oxidado
Reacciona más rápido que el Oxalato de Sodio
Son más simples que Na2C2O4
El ion OXALATO se oxida
El Permanganato se reduce
Sus uniones son más complejas
Es una reacción más lenta
La distinción de tonos en los tubos
Al aumentar la concentración, aumenta la cantidad de choques entre partículas
Aumenta la velocidad de reacción
Por una ecuación matemática
v = k [A]^X . [B]^Y
EXPERIENCIA 2
Na2C2O4 diluido y H2O + KMnO4
Lenta
La concentración del reactivo esta diluido, por consecuencia el color de la disolución tarda mas en desvanecerse
Na2C2O4 + KMnO4
Rápida desaparición del color rosa
Experiencia V
Es un factor determinante para la velocidad
Mayor es la superficie de contacto.
El reactivo y el producto
Menos tiempo tarda en consumirse este ultimo
Las partículas del primer reactivo están mas expuestas que las partículas del segundo
TUBO 2
KMnO4 0,005M
Un trozo de virulana
Tarda menos tiempo en reaccionar completamente
KMnO4 0,05 M
Un clavo de hierro
Tarda más tiempo en reaccionar completamente
Experiencia IV
Una alteración en la velocidad de la reaccion
A la diferencia de temperatura
Los tubos
La velocidad de movimiento en las moleculas
Se puede expresar
La ecuación de Arrhenius
EXPERIENCIA 4
TUBO 2
Na2C2O4 KMNO4 a temperatura ambiente
A baño maría a 55ºC
Una reacción más rápida
El aumento de temperatura
TUBO 1
Na2C2O4 + KMNO4 a temperatura ambiente
Color rosa