e = coefficiente di emissione
Costante di Stefan-Boltzmann
σ = 5,67 × 10^-8 W/(m^2 × K^4)
Lavoro meccanico
il calore ceduto da una parte del sistema è uguale al calore acquistato dall'altra
TERMOLOGIA
le caratteristiche sono dovute alla maggiore o minore intensità delle INTERAZIONI TRA MOLECOLE
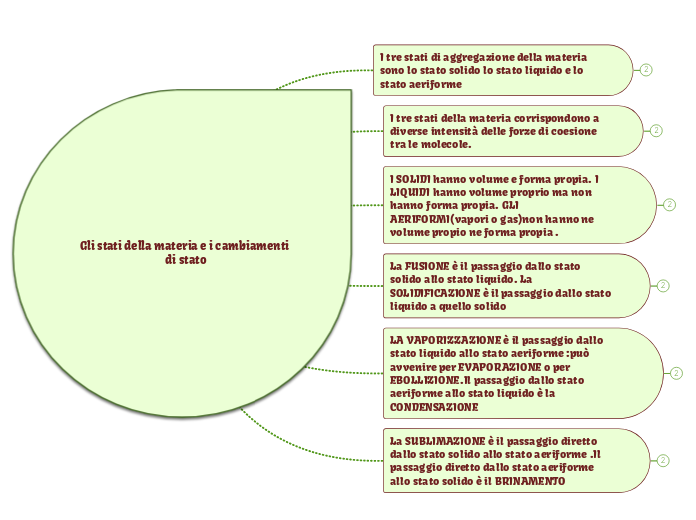
GASSOSO
occupa l'intero spazio del recipiente che lo contiene e ne assume la forma e il volume
LIQUIDO
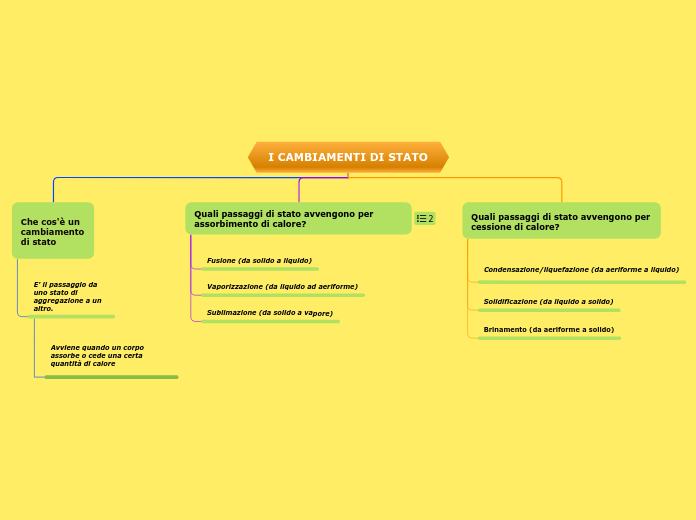
CAMBIAMENTI DI STATO
Passaggio da uno stato di aggregazione all'altro.
i sistemi che scambiano energia e calore SISTEMI TERMODINAMICI
una parte fisicamente omogenea di un sistema termodinamico è detta FASE
CAMBIAMENTI DI STATO=TRANSIZIONI DI FASE
durante un cambiamento di stato la temperatura di un sistema rimane costante
CALORE LATENTE L di una sostanza è il calore che deve essere fornito o sottratto a una massa unitaria di quella sostanza per farla passare da una fase ad un'altra.
CALORE LATENTE DI SUBLIMAZIONE Ls
CALORE LATENTE DI VAPORIZZAZIONE Lv
CALORE LATENTE DI FUSIONE Lf
L= Q/m
unità di misuta joule/kilogrammo J/Kg
BRINAMENTO o SUBLIMAZIONE
FUSIONE o LIQUEFAZIONE passaggio dalla fase solida alla liquida
SOLIDIFICAZIONE
la temperatura alla quale una sostanza passa da solido a liquido è detto PUNTO DI FUSIONE
VAPORIZZAZIONE
passaggio dallo stato liquido a quello di vapore (gassoso) CONDENSAZIONE
EBOLLIZIONE punto in cui la temperatura alla quale la pressione del vapore saturo eguaglia la pressione esterna
volume proprio, ma forma del recipiente
SOLIDO
forma e volume propri
nei solidi cristallini, le molecole formano reticoli geometrici
Calore
Caloria (cal)
1 cal = 4,186 J
Joule nel S.I.
Q = quantità di energia trasferita a causa di una differenza di temperatura
Propagazione del calore
Irraggiamento
Energia irradiata sotto forma di onde elettromagnetiche
Potenza irradiata (P)
P = e σ A T^4
Conduzione
Flusso di calore che avviene direttamente attravreso un materiale
Q = k A (ΔT/L) t
W/(m K)
Convenzione
Attraverso i fluidi
Calore specifico
c = C/m
Dipende solo dal tipo di sostanza
J/(kg K)
Capacità termica
C = Q/ΔT
Legge fondamentale della termologia
Q = m c ΔT
Q = C ΔT
Q<0 il sistema cede calore
Q>0 si fornisce calore al sistema
J/K
Quantità di calore necessario per innalzare la temperatura di un grammo d'acqua da 14,5°C a 15,5°C
Temperatura
Strumenti di misurazione
Termometri
base del funzionamento
La dilazione termica
Dilazione volume
ΔV direttamente proposizionale a V0 e ΔT
ß = coefficiente di dilatazione volumica
ΔV = ßV0ΔT = legge della dilatazione termica volumica
Dilatazione lineare
ΔT = T - T0
a = coefficiente di dilatazione lineare
ΔL = aL0ΔT = Legge della dilatazione termica
ΔL = L - L0
L0 = lunghezza iniziale
messo a contatto con il corpo si espande
scala termodinamica
zero assoluto
Gas Ideali
leggi dei gas ideali
leggi di Gay- lussac
seconda legge
a volume costante , pressione e temperatura sono direttamente proporzionali p= costante x T ( v costante )
prima legge
a pressione costante , volume e temperatura di un gas sono direttamente proporzionali
V=costante x T (p costante )
legge di Boyle
PiVi=pfVf ( numero di moli n costante , temperatufa
Mole
una mole è la quantità di sostanza che contiene tante entità elementari quanti sono gli atomi in 12g di carbonio -12
numero di avogadro , Na = 6,022 x 10^23 molecole/mol
principio di avogadro : volumi uguali di gas differenti , nelle medesime condizioni di temperatura e di pressione contengono lo stesso numero di molecole
numero di molecole : N=nNA
sostituiamo questa espressione nella relazione p= kNT/V otteniamo P=nNAkT/V= nRT/V
R costante universale dei gas : R= NAK = ( 6,022 x 10^23 molecole / mol ) ( 1,38 x10^-23 J/K) = 8,31 j / (mol K)
equazione di dtato di un gas ideale : PV=nRT
Dipendenza dalla pressione , da temperatura , da numero di molecole e volume
p= costante /V ( numero molecole N costante , temperatura T costante )
p=costante x N ( volume V costante ,temperatura T costante )
pressione di un gas ideale
La pressione di N molecole di gas alla temperatura T e con volume V è p=K (NT/V)
k costante di Boltzmann k=1,38 x 10^-23 J/K
p=costante x T ( volume V costante , numero di Molecole N costante )
la temperatura minima possibile teorica di un qualsiasi sistema termodinamico.
più diffuse Celsius, Fahrenheit, Kelvin
Kelvin
0 K = zero assoluto
1°C = 1 K
T(K)=T(°C) +273,15 T(°C) = T(K) -273,15
Fahrenheit
212°C, temperatura ebollizione acqua
32°C, temperatura del ghiaccio
Celsius
zero assoluto, -273,15°C
100°C, temperatura ebollizione acqua
0°C, temperatura del ghiaccio
due temperature di riferimento
congelamento ed ebollizione
sfrutta effetti fisici
la dilatazione che subisce un liquido (alcol o mercurio)
Grandezza fisica che determina se sono in equilibrio termico
quando due oggetti hanno la stessa temperatura