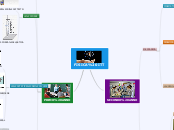
Energia Libera di Gibbs
Delta G =
Delta H Sistema - T * Delta S Sistema
G energlia liberaa
pale/ruote/eliche
S Energia dispersa
calore
H Energia disponibile
Funzione di stato che avviene
a T e P costante
Delta S ambiente =
Delta H sistema / T
in un processo spontaneo
l'entropia totale dell'unverso (Sistema + ambiente) aumenta
Classificazione del processo
in base al Delta S
NON Spontaneo
se Delta S univ < 0 il processo non è spontaneo (è spontaneo il processo inverso)
Allora vuol dire Delta G > 0
è spontane la reazione inversa
In equilibrio
Delta S univ = 0 il sistema è in equilibrio
Delta G=0
Spontaneo
In un processo spontaneo l'entropia dell'universo* aumenta
D S univ = D S sist + D S amb > 0
quindi Delta G < 0
la reazione è da sinistra verso destra
Reazioni
Reagenti / prodotti
il Delta è la differenza fra prodotti e reagenti.
Pertanto quando l'entropia dei reagenti è maggiore vuol dire che la reazione avviene facilmente
Sistema
Delta S = Q/T
che significa che la variazione di entropia è dato dal calore scambiato diviso la T
aumenta con l'aumentare della temperatura (energia cinetica maggiore)
quando si scioglie un soluto in un solvente
Molecole grandi e complesse, hanno entropia maggiore di quelle piccole e semplici
Entropia in ordine G>L>S
la conoscienza di due
grandezze di stato
entropia
Entalpia
spontaneità di una reazione
Secondo Principio della termodinamica
Il
secondo principio della termodinamica
può essere espresso secondo varie formulazioni equivalenti tra cui quella che introduce la funzione di stato
entropia
.
Esso può essere espresso considerando che in un sistema isolato l’entropia è una funzione non decrescente nel tempo ovvero dS/dt ≥ 0.
In termodinamica un sistema è una porzione di spazio separata dall’ambiente esterno; sistema e ambiente esterno sono le componenti dell’universo.
Un sistema si dice:
- Aperto se consente un flusso di massa o di energia con l’ambiente esterno
- Chiuso se consente un flusso di energia ma non di massa con l’ambiente esterno
- Isolato se non permette un flusso né di massa né di energia con l’ambiente esterno
Durante una trasformazione l’entropia dell’ambiente esterno subisce una variazione ΔSamb e pertanto la varazione dell’entropia dell’universo subisce la variazione complessiva:
ΔSun = ΔSamb + ΔSsis
Per comprendere questa relazione si consideri il processo del flusso di calore tra due oggetti, uno identificato come il sistema e l’altro come l’ambiente circostante. Vi sono tre possibilità:
- Gli oggetti hanno temperature diverse e il calore fluisce spontaneamente dall’oggetto più caldo a quello più freddo. indentificando l’oggetto più caldo come sistema e quello più freddo come ambiente si ha, per definizione di entropia:
ΔSsis = – qrev/Tsis
ΔSamb = qrev/Tamb
Le due grandezze qrev sono uguali e di segno opposto e rendono conto del fatto che il sistema perde calore mentre l’ambiente lo guadagna. Poiché Tsis > Tamb la diminuzione di entropia del sistema è minore rispetto all’aumento di entropia dell’ambiente:
│ ΔSsis │< │ ΔSamb│
quindi l’entropia dell’universo aumenta:
ΔSun = ΔSamb + ΔSsis > 0
- Gli oggetti hanno temperature diverse e il calore fluisce dall’oggetto più freddo a quello più caldo, processo che non è mai stato osservato avvenire spontaneamente. Infatti usando la precedente notazione di ha che
ΔSsis = qrev/Tsis
ΔSamb = – qrev/Tamb
Poiché Tamb > Tsis la diminuzione di entropia del sistema è maggiore rispetto all’aumento di entropia del sistema:
│ ΔSsis │> │ ΔSamb│
quindi l’entropia dell’universo diminuisce:
ΔSun = ΔSamb + ΔSsis < 0
e ciò è in contrasto con il secondo principio della termodinamica pertanto il processo non avviene spontaneamente
Gli oggetti hanno la stessa temperatura quindi │ ΔSsis │= │ ΔSamb│ e pertanto
ΔSun = ΔSamb + ΔSsis = 0
Questi risultati portano a una correlazione tra variazione di entropia e spontaneità di un processo che vengono riassunti nella tabella:
ΔSun > 0Processo spontaneoΔSun < 0Processo non spontaneoΔSun = 0Processo all’equilibrio
Entropia
Misura la quantità di calore per Mole di sostanza
cal/ Kmoli