ENLACES QUIMICOS
¿Qué es?

ES:
Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o iones, para así tener menor energía y mayor estabilidad.

Longitud de enlace
Es la distancia que hay entre dos núcleos, donde para esta distancia la energía es mínima y la estabilidad es máxima.
Energía de enlace
Es la energía que se desprende al formarse un enlace, o la que se utiliza para romper este.

Electrones de valencia
Son los e- del último nivel de energía de los átomos.

NOTACIÓN DE LEWIS
Es la representación convencional de los e- de valencia mediante el uso de puntos que se colocan alrededor del símbolo del elemento.
IÓNICO
Se da entre un metal que pierde e- y un no metal que los captura, se mantienen unidos por atracciones electrostáticas, formando redes cristalina.

Se produce cuando el elemento metálico pierde e- y el no metálico gana e- y se forman partículas llamadas iones.
ANIÓN
Es cuando el átomo no metálico gana electrones.
CATIÓN
Es cuando el átomo metálico pierde electrones.

PROPIEDADES
Puntos de fusión y ebullición elevados.
Sólidos a temperatura ambiente.
Gran dureza, frágiles.
Solubilidad en disolventes polares.
Insolubilidad en disolventes apolares.
Conductividad en estado disuelto o fundido
EXCEPCIONES
Son enlaces iónicos a pesar de que solo están formados por elementos metálicos.
NH4Cl
NH4NO3
(NH4)2SO4

ELECTRONEGATIVIDAD
Capacidad que tiene un átomo de atraer e- comprometidos en un enlace.
Los elementos que entre sí tienen gran diferencia de electronegatividad, y si la diferencia es mayor a 1.7 entonces el enlace será iónico.
COVALENTE
Se da entre dos átomosneutros no metálicos por compartición de e- de valencia.
Es la fuerza electromagnética que mantiene unidos a átomos que comparten e-, tienen espines o giros opuestos
TIPOS

Polar
Los e- enlazantes no son compartidos en forma equitativa por los átomos, no presentan geometría simétrica y su diferencia de electronegatividad es diferente de 0.

Apolar
Los átomos comparten equitativamente a los e-. La diferencia de electronegatividad=0

Dativo/Coordinado
Un átomo aporta un par de e- para el enlace
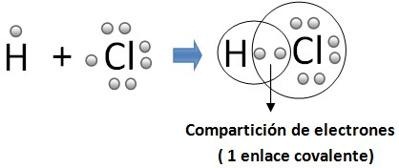
Normal
Cada átomo aporta un e- a la formación del enlace

PROPIEDADES
Pueden ser sólidos, líquidos o gaseosos a temperatura ambiente.
pueden ser sólidos cristalinos.
Tienen baja temperatura de fusión y ebullición.
Son insolubles en agua.
Son solubles en solventes apolares.
Son aislantes.
Teoría de Lewis

REGLA DEL OCTETO
Los átomos para conseguir 8e-ensu última capa comparten tantos e- como le falten para completar su capa.
Cada pareja de e- compartidos forman en enlace.
Se pueden formar enlaces sencillos, dobles y triples con el mismo átomo.
Clasificación
Enlace simple
Dos electrones

Theory
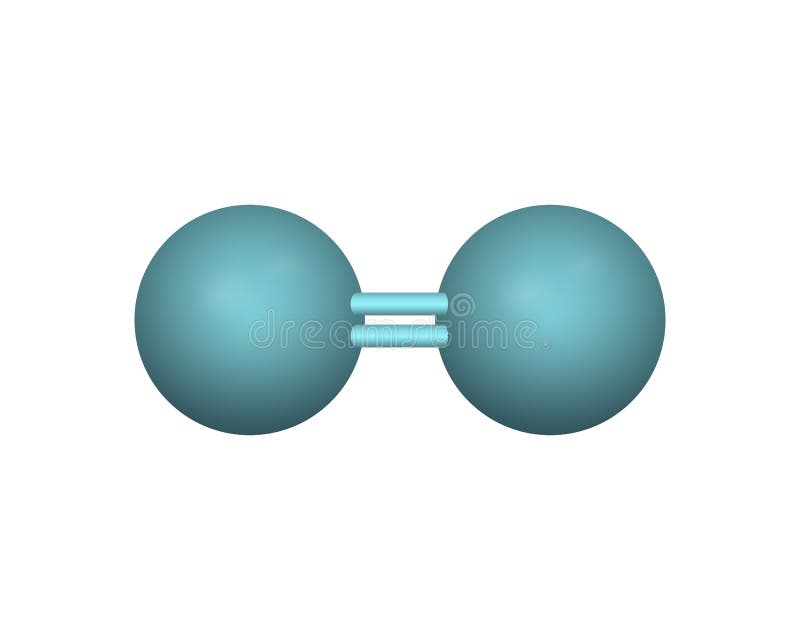
Enlace doble
Cuatro electrones
Theory
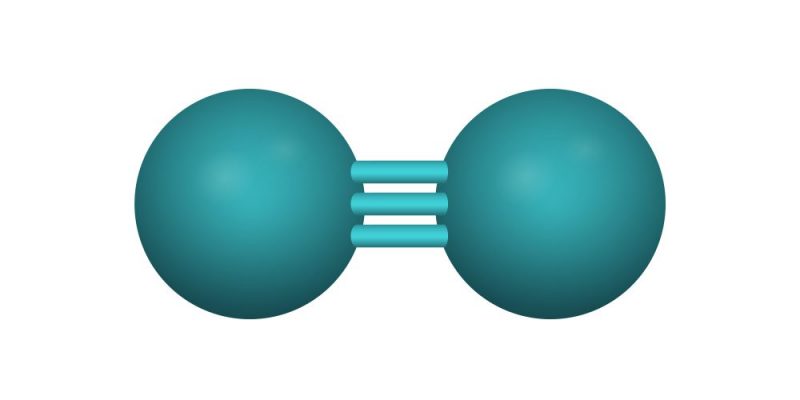
Enlace triple
Seis electrones
Theory
