LA EVOLUCIÓN DEL MODELO ATÓMICO
DEMÓCRITO (5000AC)
La materia como mezcla de elementos que poseen las mismas características, comprendidos de entidades infinitamente pequeñas, que no podríamos observar a simple vista a los cuales nombró como Átomos
Características del modelo Demócrito
1) Los átomos son eternos, indivisibles, homogéneos, incompresibles e invisibles.
2) Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas.
3) Las propiedades de la materia varían según el agrupamiento de los átomos.

DALTON (1803)
Este modelo se considera al átomo como la partícula fundamental de la materia
Características
1) Los elementos están formados por átomos.
2) Los átomos de un mismo elemento son todos iguales entre sí.
3) Los compuestos se forman por la unión de átomos de distintos elementos, combinados de manera sencilla y constante formando entidades bien definidas llamadas moléculas.
Molécula
THOMPSON (1897)
En este modelo El átomo era una esfera de masa positiva uniforme, en la que se encontraban insertas las cargas negativas, lo que explicaba la neutralidad eléctrica de la materia
Características
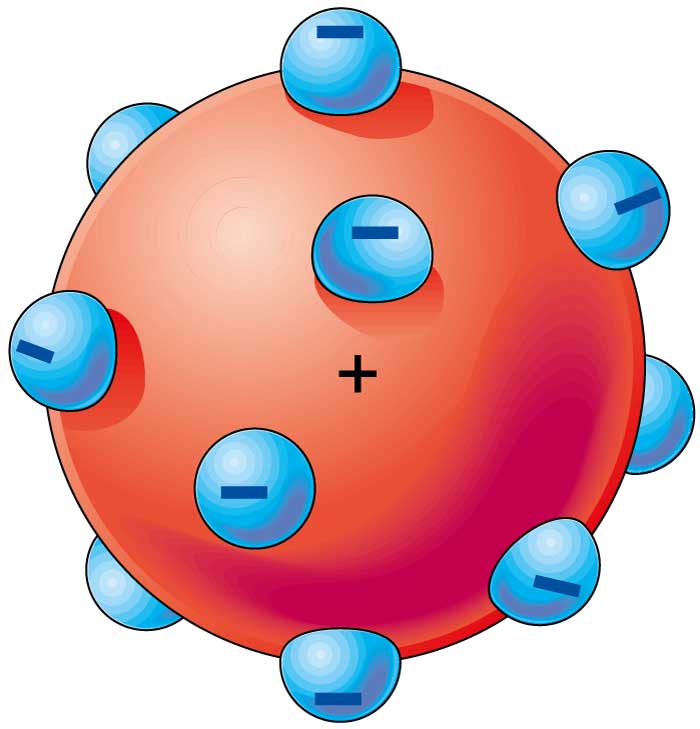
Más conocido como pastel de frutas
La mayoría de la masa estaba asociada con la carga positiva y que había un número determinado de electrones distribuidos uniformemente dentro de esa masa con carga positiva.
RUTHERFORD (1908)
Rutherford fue discípulo de Thompson; e identificó dos tipos de radiaciones a las que llamó alfa (α) y beta (β). Gracias a su experiencia en radiación, estableció un modelo molecular, que tiene las siguientes características
Características
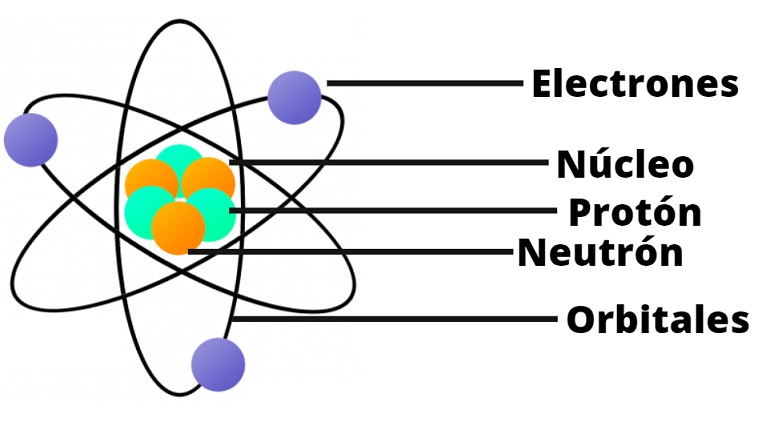
1) El átomo tiene un núcleo central en el que está concentrada la carga positiva, y casi toda su masa.
2) En la zona exterior (corteza) se encuentra la carga negativa que está formada por electrones.
3) El núcleo contiene protones.
4) Los electrones giran alrededor del núcleo y están separados de éste por una gran distancia.
5) El tamaño del núcleo es muy pequeño en comparación con la del átomo.
BOHR (1913)
Bohr realizó estudios con hidrógeno y gracias a esto estableció que:
1) Los átomos que tienen el mismo número de electrones de valencia y que poseen distintos números, tienen características similares.
2) Los átomos tienen un núcleo demasiado pequeño y denso que contiene partículas subatómicas. 3)Los electrones se encuentran en diferentes órbitas alrededor del núcleo.
4) Los átomos son eléctricamente neutros, pero si tienen electrones cargados negativamente, deben contener otras partículas con carga positiva (protones).
5) Chadwick descubre que el núcleo está compuesto por protones y neutrones.