MODELO ATÓMICO

Demócrito
400 A.C - 370 A.C

El átomo es la fracción más pequeña posible de cada sustancia.
El átomo es sólido y sin estructura interna.
Los átomos de los distintos materiales pueden diferir en tamaño, forma o masa.

John Dalton
6/9/1766 - 27/7/1844

Propuso que toda materia está hecha de pequeñas partículas indivisibles llamadas átomos, que imaginó como "partículas sólidas, masivas, duras, impenetrables y en movimiento".
Sir Joseph John Thomson
18/12/1856 - 30/8/1940

El átomo está formado por electrones de carga negativa incrustados en una esfera de carga positiva como en un "pudin de pasas". Los electrones están repartidos de manera uniforme por todo el átomo.
Evento
Ernest Rutherford
30/8/1871 - 19/10/1937

El átomo tiene un núcleo central en el que están concentradas la carga positiva y toda la masa. La carga positiva de los protones es compensada con la carga negativa de los electrones.

Niels Henrik David Bohr
7/10/1885 - 18/11/1962
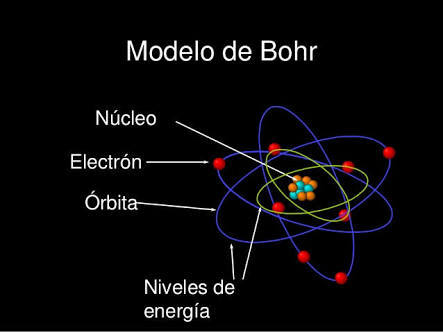
Demostró que cuando un electrón
pasaba de una órbita más externa
a una más interna emitía radiación
electromagnética.

Louis Victor de Broglie
15/8/1892 - 19/3/1987

Los electrones se perciben como
ondas que se movilizan en toda
la órbita sin una ubicación específica.

Erwin Schrödinger
12/8/1887 - 4/1/1961
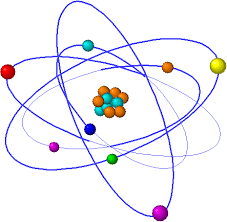
Propuso una ecuación de onda
que ayuda a predecir donde se
encuentra el electrón. Se conoce
como "ecuación de Schrödinger".

James Chadwich
20/10/1891 - 24/7/1974

Se centra en la modelación
del núcleo atómico constituido
no solo por protones (cargas
positivas), sino también por
neutrones (cargas negativas).

George Zweing
1937/ACTUALIDAD

QUARKS: Esas partículas, además
de los protones y neutrones, estaban
formadas por otras partículas elementales,
llamadas quarks.
Los quarks se mantienen unidos gracias al
intercambio de gluones.