Química orgánica
Historia
A principios del siglo diecinueve se habían acumulado muchas pruebas sobre la naturaleza, propiedades físicas y reacciones de los compuestos inorgánicos, pero se sabía relativamente poco sobre los compuestos orgánicos.

Se desarrolló una corriente de pensamiento conocida como vitalismo, según la cual los compuestos orgánicos, propios de los seres vivos, solo podían existir y ser sintetizados por organismos vivos, los cuales imprimían su fuerza o esencia vital a dichos procesos

Wohler descubrió, en 1828, que al calentar
una solución acuosa de cianato de amonio, una sal inorgánica, se producía urea, compuesto orgánico presente en la orina de algunos animales. Esto mostraba que era posible sintetizar compuestos orgánicos sin la intervención de seres vivos, es decir, sin la mediación de una fuerza vital. Se demostró que extractos de células muertas podían generar reacciones orgánicas, con lo cual se habían descubierto las enzimas.

El químico alemán August Kekule (1829-1896) propuso que los compuestos orgánicos se estructuraban sobre un esqueleto básico de átomos de carbono, en el cual se insertaban átomos de otros elementos. El aporte más importante de Kekule fue el elucidar la estructura del benceno, compuesto de gran importancia, industrial y bioquímica.
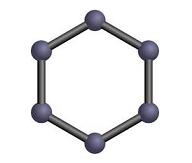
En las primeras décadas del siglo XX, surge la bioquímica como rama de la química encargada del estudio de los compuestos y los procesos de tipo orgánico. En 1944 se descubre que los genes son fragmentos de ácidos nucleicos y que éstos constituyen el código de la estructura química de los seres vivos. Luego, en 1953, Watson y Crick descubren la estructura tridimensional del ADN.

Hoy se admite que el rasgo común entre los compuestos clasificados como orgánicos es que todos ellos contienen el elemento carbono. En consecuencia, la definición moderna de química orgánica es la de química de los compuestos del carbono.

Diferencias entre compuestos
orgánicos y compuestos
inorgánicos
Todos los compuestos orgánicos utilizan como base de construcción el átomo de carbono y unos pocos elementos más, mientras que en los compuestos inorgánicos participan la gran mayoría de los elementos conocidos.
Están formados por enlaces covalentes, mientras que en los compuestos inorgánicos predominan los enlaces iónicos.
La mayoría presentan isómeros, sustancias que poseen la misma fórmula molecular pero difieren en la organización estructural de los átomos, es decir, la forma tridimensional de las moléculas es diferente. Por esta razón las propiedades físico-químicas cambian entre isómeros. Contrariamente,
entre las sustancias inorgánicas los isómeros son raros.topic
Por lo general están formados por gran número de átomos organizados en largas cadenas basadas en carbono, sobre las cuales se insertan otros elementos. En los compuestos inorgánicos —con excepción de algunos silicatos— la formación de cadenas no es común.
La variedad de los compuestos orgánicos es muy grande comparada con
la de los compuestos inorgánicos.
La mayoría son insolubles en agua y solubles en solventes orgánicos.
Los compuestos orgánicos presentan puntos de fusión y ebullición bajos;
los compuestos inorgánicos se caracterizan por sus elevados puntos de fusión y ebullición; esto se explica por el carácter iónico de sus enlaces.
Importancia
de la química orgánica
El estudio de la química orgánica es la base para la comprensión del funcionamiento de los seres vivos, aspecto estudiado específicamente por la bioquímica.

lugar, la posibilidad de extraer, purificar y modificar intencionalmente una gran variedad de compuestos orgánicos, así como el desarrollo de procesos industriales con los cuales ha sido viable la síntesis artificial de otros compuestos, ha revolucionado la forma de vida de las personas en la civilización actual.

Algunos ejemplos de productos
derivados de compuestos orgánicos son: el papel, las telas de algodón, los combustibles (petróleo, ACPM, carbón), las drogas (como la penicilina) y las vitaminas. Así mismo, compuestos orgánicos sintetizados artificialmente son: los plásticos, los detergentes, los pesticidas, los colorantes, algunas fibras (rayón, dacrón, nailon, orlón) y algunas drogas (como la cortisona y varios antibióticos)




Elementos que constituyen
los compuestos orgánicos
Si se analiza la composición de la materia en términos de la proporción relativa de los diferentes elementos presentes, se encuentra que cerca del 95% de la masa está constituida por carbono, hidrógeno, oxígeno, nitrógeno y azufre. El porcentaje
restante está representado por elementos como calcio, fósforo,hierro, magnesio, entre otros. Los elementos presentes en los seres vivos se denominan bioelementos. Los cinco elementos más abundantes (C, H, O, N y S) son indispensables para la síntesis de las moléculas que conforman los seres vivos, por lo que se conocen como bioelementos primarios o elementos biogenésicos u organógenos.
Hidrógeno
El hidrógeno se encuentra únicamente en estado libre en la naturaleza en muy pequeña cantidad. La atmósfera contiene menos de una parte de hidrógeno en un millón de partes de aire aunque se cree que en las capas superiores de la atmósfera la proporción de hidrógeno es un poco mayor.
Combinado, el hidrógeno representa el 11,9% del agua; se encuentra también en todos los ácidos y es un constituyente importante de los compuestos orgánicos denominados hidrocarburos-

Oxígeno
El oxígeno participa en los procesos de respiración animal y vegetal. El oxígeno del aire se combina con la hemoglobina de la sangre, luego es transportado a todas las partes del cuerpo y liberado para oxidar productos orgánicos; la energía liberada se utiliza en el metabolismo del cuerpo. También es necesario
para la locomoción, para el aprovisionamiento de calor en el cuerpo y para el crecimiento.

Nitrógeno
Es un gas inodoro, incoloro e insípido que constituye alrededor del 75% en peso y el 78% en volumen de la atmósfera. La explicación de la gran abundancia del nitrógeno en la atmósfera y de la relativa escasez de sus compuestos está dada por la gran inercia química que presenta su molécula. Sin embargo, la naturaleza provee mecanismos mediante los cuales los átomos de nitrógeno se incorporan a las proteínas, ácidos nucleicos y otros compuestos nitrogenados. Uno de los más importantes es el NO2

Azufre
Constituye alrededor del 0,05% de la corteza terrestre y se presenta como elemento libre, en forma de sulfuros metálicos como galena (PbS), pirita ferrosa (FeS2), cinabrio (HgS) y en los gases volcánicos en forma de sulfuro de hidrógeno (H2S) y dióxido de azufre (SO2). Forma también parte de materia orgánica como el petróleo y el carbón. Su presencia en los combustibles fósiles produce problemas ambientales y de salud.

