INVIMA
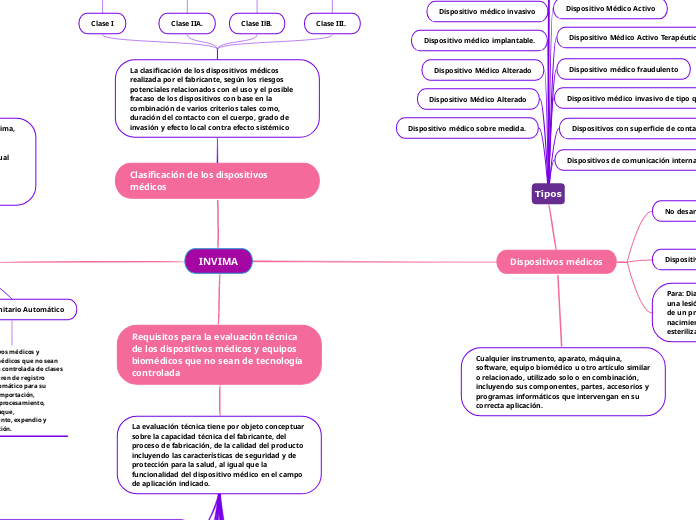
Dispositivos médicos
No desarrollan una acción terapéutica
Dispositivos Médicos Combinados
Si la función principal es la de ser dispositivo y la del fármaco es accesoria, se cataloga como dispositivo médico.
Para: Diagnóstico, prevención, supervisión o alivio de una enfermedad, tratamiento, alivio o compensación de una lesión o de una deficiencia, Investigación, sustitución, modificación o soporte de la estructura anatómica o de un proceso fisiológico, Diagnóstico del embarazo y control de la concepción, Cuidado durante el embarazo, nacimiento o después del mismo, incluyendo el cuidado del recién nacido,Productos para la desinfección y/o esterilización de dispositivos médicos.
dispositivo médico
Cualquier instrumento, aparato, máquina, software, equipo biomédico u otro artículo similar o relacionado, utilizado solo o en combinación, incluyendo sus componentes, partes, accesorios y programas informáticos que intervengan en su correcta aplicación.
Tipos
Dispositivo médico terminado.
Dispositivo Médico Activo
Dispositivo Médico Activo Terapéutico
Dispositivo médico fraudulento
Dispositivo médico invasivo de tipo quirúrgico
Dispositivos con superficie de contacto.
Dispositivos de comunicación interna y externa.
Dispositivo médico quirúrgico reutilizable
Dispositivo médico invasivo
Dispositivo médico implantable.
Dispositivo Médico Alterado
Dispositivo Médico Alterado
Dispositivo médico sobre medida.
Clasificación de los dispositivos médicos
La clasificación de los dispositivos médicos realizada por el fabricante, según los riesgos potenciales relacionados con el uso y el posible fracaso de los dispositivos con base en la combinación de varios criterios tales como, duración del contacto con el cuerpo, grado de invasión y efecto local contra efecto sistémico
Clase I
Bajo riesgo, sujetos a controles generales, no destinados para proteger o mantener la vida o para un uso de importancia especial en la prevención del deterioro de la salud humana y que no representan un riesgo potencial no razonable de enfermedad o lesión.
Clase IIA.
Riesgo moderado, sujetos a controles especiales en la fase de fabricación para demostrar su seguridad y efectividad.
Clase IlB.
Riesgo alto, sujetos a controles especiales en el diseño y fabricación para demostrar su seguridad y efectividad.
Clase III.
Muy alto riesgo sujetos a controles especiales, destinados a proteger o mantener la vida o para un uso de importancia sustancial en la prevención del deterioro de la salud humana, o si su uso presenta un riesgo potencial enfermedad o lesión.
Registro sanitario
Registro Sanitario Control Previo
Los dispositivos médicos y equipos biomédicos que no sean de tecnología controlada de clases IIB y III, requieren de registro sanitario, para su producción, importación, exportación, procesamiento, envase, empaque, almacenamiento, expendio y comercialización, previo el cumplimiento de los requisitos técnicos-científicos y sanitarios.
Registro Sanitario Automático
Los dispositivos médicos y equipos biomédicos que no sean de tecnología controlada de clases I y IIA, requieren de registro sanitario automático para su producción, importación, exportación, procesamiento, envase, empaque, almacenamiento, expendio y comercialización.
Es el documento público expedido por el Invima, cuando el usuario cumple con los requisitos técnicos, científicos, sanitarios y legales establecidos en el decreto 4725 de 2005, el cual faculta a una persona natural o jurídica para producir, comercializar, importar, exportar, envasar, empaque, procesar, expender y/o almacenar un dispositivo médico.
Requisitos para la evaluación técnica de los dispositivos médicos y equipos biomédicos que no sean de tecnología controlada
La evaluación técnica tiene por objeto conceptuar sobre la capacidad técnica del fabricante, del proceso de fabricación, de la calidad del producto incluyendo las características de seguridad y de protección para la salud, al igual que la funcionalidad del dispositivo médico en el campo de aplicación indicado.
Formulario debidamente diligenciado y avalado por el director técnico
Nombre generico, comercial de marca, presentacion comercial, nombre del fabricante, modalidad de registro, vida util, Clasificación de acuerdo al riesgo, Indicaciones y usos, Código internacional (UMDNS, GMDN, UDI u otro de igual reconocimiento internacional), Advertencias, precauciones y contraindicaciones., Componentes y composición del producto y Referencias