Entre los generadores de potencia termodinámicos hablaremos del ciclo de Carnot y el ciclo de Rankine
Ciclo de Carnot
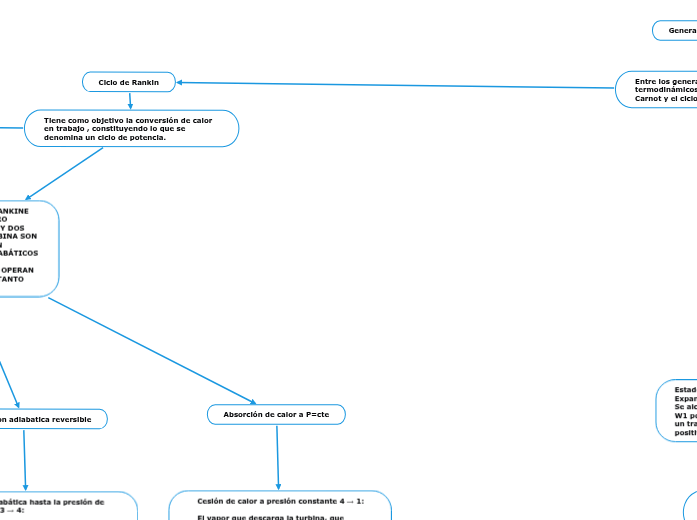
Ciclo de Rankin
Tiene como objetivo la conversión de calor en trabajo , constituyendo lo que se denomina un ciclo de potencia.
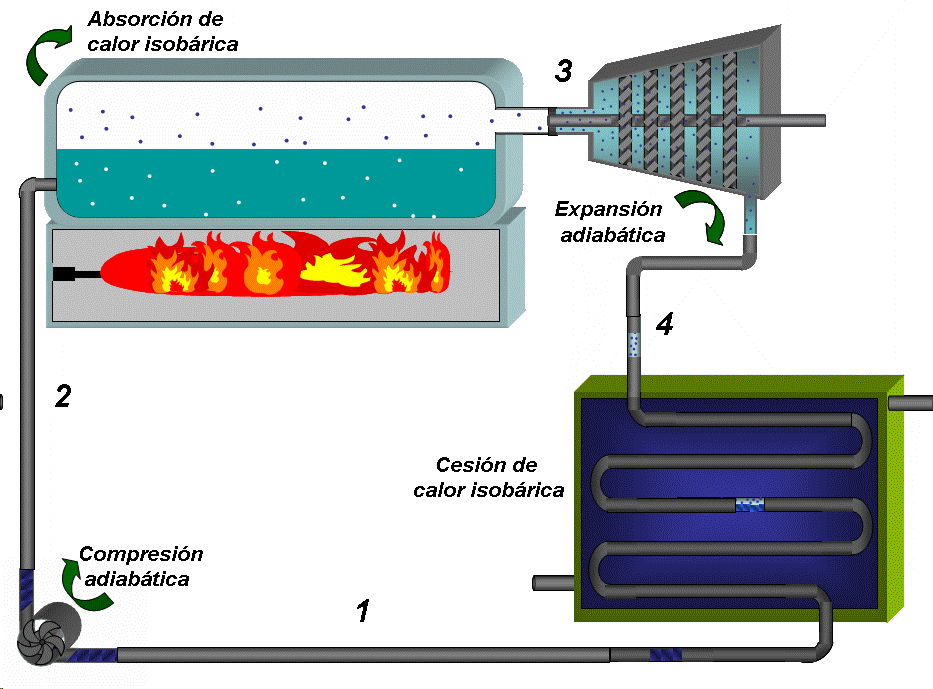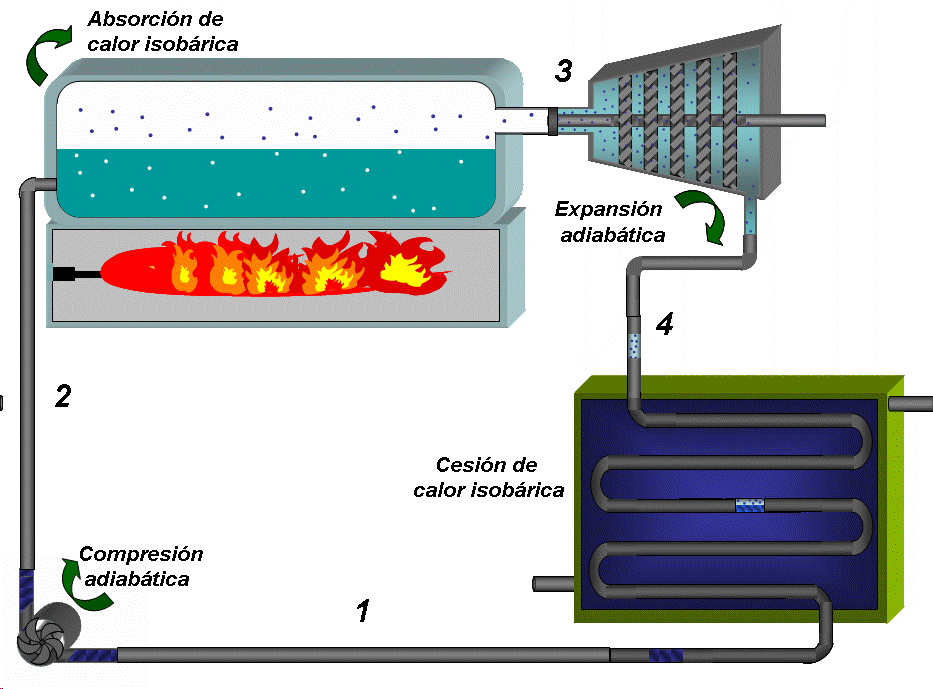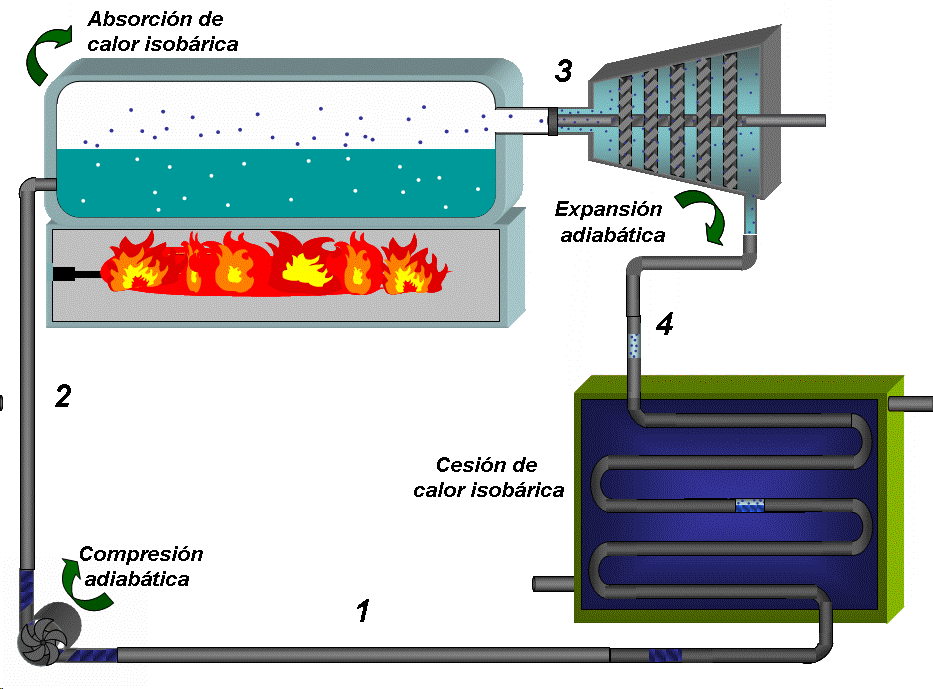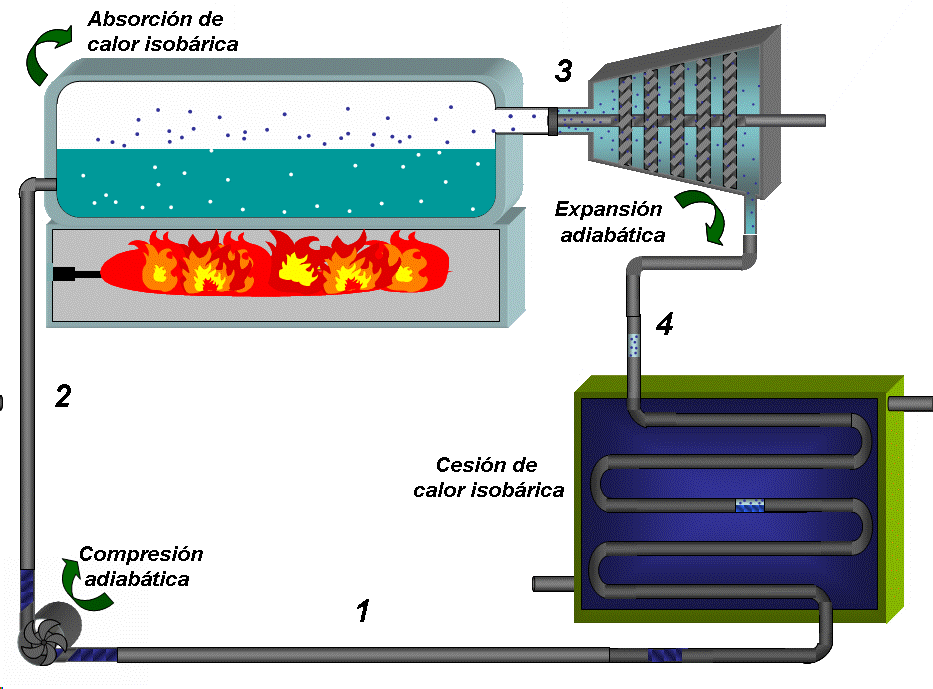
EL DIAGRAMA T-S DE UN CICLO RANKINE IDEAL ESTÁ FORMADO POR CUATRO PROCESOS, DOS ISOENTRÓPICOS Y DOS ISOBÁRICOS.LA BOMBA Y LA TURBINA SON LOS EQUIPOS QUE OPERAN SEGÚN PROCESOS ISOENTRÓPICOS (ADIABÁTICOS E INTERNAMENTE REVERSIBLES).
LA CALDERA Y EL CONDENSADOR OPERAN SIN PERDIDAS DE CARGA Y POR TANTO SIN CAIDAS DE PRESIÓN.
Expansión adiabática reversible
La bomba colecta condensado a baja presión (menor que la atmosférica) y baja temperatura, que es el estado 1 y comprime el agua hasta la presión de la caldera (estado 2), lo que requiere de un trabajo que denominaremos como Wentra
Expulsión de calor a P=cte
Absorción de calor a P = constante 2 →3:
El condensado a menor temperatura que la de saturación prevaleciente en la caldera, se inyecta en esta última. En la caldera primero se calienta, alcanzando la saturación (que se representa por el punto A en el diagrama TS) y luego se inicia la ebullición del líquido. Todo este proceso requiere del suministro de calor que denominaremos como Qentra. El vapor que se extrae de la caldera (con un título muy cercano a 1) constituye el estado 3
Comprension adiabatica reversible
Expansión adiabática hasta la presión de condensación 3 → 4:
El vapor se conduce a la turbina donde se expande hasta la presión asociada a la temperatura de condensación, generando trabajo, que denominaremos como Wsale.
Absorción de calor a P=cte
Cesión de calor a presión constante 4 → 1:
El vapor que descarga la turbina, que constituye el estado 4 entra al condensador donde se convierte en agua al entrar en contacto con las paredes de tubos que están refrigerados en su interior (típicamente por agua), entregándose una cantidad de calor a la temperatura TF que denominaremos como Qsale. El condensado se colecta en el fondo del condensador, donde se extrae prácticamente como líquido saturado que se dirige a la bomba y se repite el ciclo..
LOS ESTADOS PRINCIPALES DEL CICLO QUEDAN DEFINIDOS POR LOS SIGUIENTES PUNTOS:
1. VAPOR SOBRECALENTADO
2. MEZCLA BAFÁSICA DE TITULO ELEVADO O VAPOR HÚMEDO
3. LIQUIDO SATURADO
4. LIQUIDO SUBENFRIADO
Se denomina ciclo termodinámico a cualquier serie de procesos termodinámicos tales que, al transcurso de todos ellos, el sistema regresa a su estado inicial
Generadores de Potencia

Consideramos ahora el efecto global del ciclo.
El trabajo neto W realizado durante el ciclo por el sistema será el representado por la superficie encerrada en el trayecto 1-2-3-4-1.
La cantidad neta de energía calorífica recibida por el sistema será la diferencia entre Q2 y Q1.
Para calcular el rendimiento de un ciclo de Carnot se emplea la misma expresión mencionada anteriormente:




referencias
fisicaestadistica y termodinamoca/el ciclo de carnot.
http://www.sc.ehu.es/sbweb/fisica/estadistica/carnot/carnot.htm
thermal Engineering/¿Que es el proceso reversible
https://www.thermal-engineering.org/es/que-es-el-proceso-reversible-definicion/
energia solar/Proseso isotermico
https://solar-energia.net/termodinamica/procesos-termodinamicos/proceso-isotermico
Termodinamica primer principio/Transformacionadiabatica
http://www2.montes.upm.es/dptos/digfa/cfisica/termo1p/primerpadiab.html
Es un proceso cíclico reversible que utiliza un gas perfecto, y que consta de dos transformaciones isotérmicas y dos adiabáticas, tal como se muestra en la figura.
Utiliza dos fuentes una de Baja temperatura y otra a Alta temperatura las cuales sin importar la cantidad de calor que se transfiera permanecen constantes.
El ciclo se divide en cuatro etapas, cada una de las cuales se corresponde con una transformación termodinámica básica:
Expansión isotérmica
Estado de equilibrio inicial : p1, V1, T1 Expansión isotérmica entre 1 y 2 Se alcanza los valores p2, V2, T1,=trabajo W1 positivo (aumenta el volumen, luego es un trabajo hecho por el sistema, trabajo positivo), comunicando energía al entorno

Expansión adiabática
Se parte del punto 2 y se llega al estado 3.
Proceso adiabático(no hay transferencia de calor) el gas debe realizar un trabajo, elevando el émbolo, para lo que el cilindro debe estar aislado térmicamente, alcanzándose los valores p3, V3, T2.
Compresión isotérmica
Entre los estados 3 y 4, hasta alcanzar los valores p4, V4, T2, siendo el trabajo realizado por el pistón. Trabajo de compresión (negativo), se recibe energía del entorno en forma de trabajo y se cede una energía equivalente en forma de calor:

Compresión adiabática
Entre los estados 4 y 1 cerrándose el ciclo.
Se alcanzan de nuevo los valores p1, V1, T1 sin transferencia de calor con el exterior.
"ISOTERMICA"
"ADIABATICA"
Se define el coeficiente adiabático de un gas (γ) a partir de las capacidades caloríficas molares tomando distintos valores según el gas sea monoatómico o diatómico: En una transformación adiabática no se produce intercambio de calor del gas con el exterior (Q = 0).
Es una transformación termodinámica a temperatura constante, es decir, una variación del estado de un sistema físico durante el cual la temperatura del sistema no cambia con el tiempo.