Tabla periódica
Descripción
Organización
Períodos
7 filas horizontales
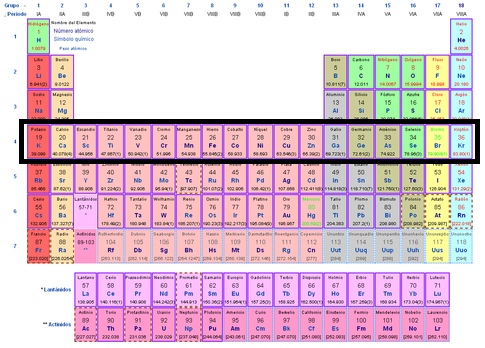
Grupos
18 columnas
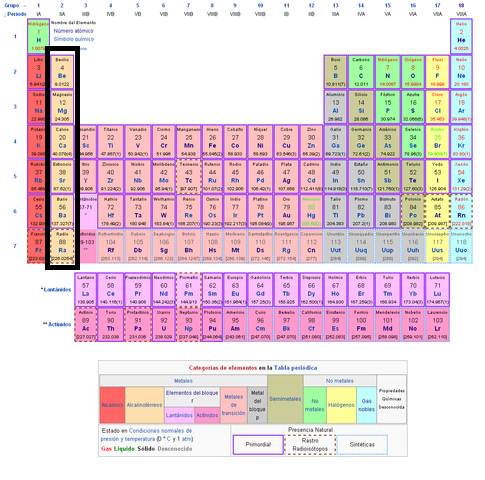
Grupo A
Se les denomina elementos representativos, debido a que sus propiedades dentro de la familia varían de forma muy regular.
Grupo B
Se les denominan elementos de transición, en este caso la configuración electrónica de sus átomos neutros termina en el subnivel “d”.
IUPAC
Unión internacional de química pura y aplicada
llegó a ser un importante instrumento para mantener el diálogo científico técnico entre científicos de distintas nacionalidades a lo largo del mundo.

Propiedades químicas
Electronegatividad
Es la capacidad que tiene un elemento (átomo) para atraer electrones. Fue definida por el químico estadounidense Linus Pauling.
Radio atómico
Es la mitad de la distancia internuclear de dos átomos idénticos unidos mediante enlace químico.
Energía de ionización
Es la mínima energía requerida para quitar un electrón de un átomo en su estado gaseoso y poder transformarlo a un catión
Afinidad electrónica
También se denomina electroafinidad, es la energía liberada o absorbida cuando un átomo gana 1 e- en su último nivel y en el estado gaseoso. Los valores más altos de esta propiedad corresponden a no metales como el cloro
Carácter metálico
El carácter metálico (C.M.), significa la tendencia de un elemento para perder electrones (oxidación) en este caso el elemento se denomina agente reductor. Los metales poseen baja electronegatividad y son buenos agentes reductores
Carácter no metálico
El carácter no metálico (C.N.M.), significa la tendencia de un elemento para ganar electrones (reducción), en este caso el elemento se denomina agente oxidante, los no metales poseen alta electronegatividad y son agentes oxidantes.
